Projekt Bio-Fun - für mehr Nachhaltigkeit
Unschädliches Bio-Fungizid macht Schadpilze für Pflanzen „sichtbar“

Das Projekt Bio-Fun will ein Biofungizid entwickeln, dass keine schädlichen Nebenwirkungen mehr hat. Das könnte die Landwirtschaft nachhaltiger und die Agrarlandschaften artenreicher machen. (Bildquelle: © www.pflanzenforschung.de / DALL.E)
Viele Fungizide sind schädlich für die Gesundheit von Menschen, Tieren, Pflanzen und die Mikrobengemeinschaften im Boden. Neuartige Bio-Fungizide sollen hingegen gezielt auf Pathogenitätsfaktoren abzielen, damit Nützlinge oder Symbionten geschont werden.
Chitin ist ein wichtiger Bestandteil der Zellwand von Pilzen. Weil es so wichtig ist und in wirklich jedem Pilz vorkommt, dient es als Signalmolekül für das menschliche und pflanzliche Immunsystem. Die Immunzellen erkennen Eindringlinge anhand des Chitins und setzen Abwehrmechanismen in Gang.
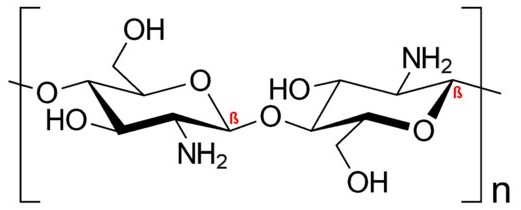
Das Molekül Chitosan. Damit Chitin die Anwesenheit pathogener Pilze nicht verrät, maskieren die Pilze das Molekül. Dazu wandeln sie Chitin mit Hilfe der Chitin-Deacetylase in Chitosan um. Das Abwehrsystem der Pflanze ist dann weitgehend „blind“.
Bildquelle: © Qniemiec / Wikipedia
Manche Schadpilze haben jedoch einen genialen Weg gefunden, sich vor dem Immunsystem zu verstecken. Sie wandeln Chitin mit Hilfe der Chitin-Deacetylase in Chitosan um. „Die Umwandlung von Chitin in Chitosan wirkt wie ein Unsichtbarkeits-Umhang für die Krankheitserreger“, sagt Bruno Moerschbacher. Er ist Professor an der Universität Münster und forscht schon lange zu Chitin und Chitosan.
In Diskussionen mit seiner wissenschaftlichen Mitarbeiterin Dr. Ratna Singh kam die Idee auf, neue Fungizide zu entwickeln, die genau an diesem Punkt ansetzen.
Die Projektpartner und das übergeordnete Ziel
- Prof. Dr. Bruno Moerschbacher (Projektkoordinator), Westfälische-Wilhelms-Universität, Münster
- Dr. Ratna Singh, Westfälische-Wilhelms-Universität, Münster
- Prof. Dr. Perali Ramu Sridhar, University of Hyderabdad, Hyderabdad, Indien
- Prof. Dr. Rengarajan Balamurugan, University of Hyderabdad, Hyderabdad, Indien
Dr. Singh ist Bioinformatikerin, Prof. Moerschbacher Biochemiker. Das Team wurde ergänzt durch zwei Zuckerchemiker der Universität Hyderabad in Indien, Prof. Dr. Perali Ramu Sridhar und Prof. Dr. Rengarajan Balamurugan.
Ziel des Projekts ist es, Moleküle zu designen, die das Enzym Chitin-Deacetylase inhibieren. Chitin kann dann nicht mehr zu Chitosan umgewandelt werden und das pflanzliche (und menschliche) Immunsystem kann die krankmachenden Pilze erkennen. Besonders wichtig ist dabei die Spezifität des Inhibitors, der nur die pilzlichen Zielenzyme hemmen soll, ohne Nebenwirkungen auf ähnliche Enzyme in der Pflanze oder im Menschen.
Das Vorgehen
Zunächst hat Ratna Singh große Datenbanken mit passenden Algorithmen durchforstet, um herauszufinden, ob es vielleicht bereits Naturstoffe gibt, die perfekt an die Chitin-Deacetylase binden. „Leider waren die wenigen Stoffe, die sehr gut gebunden haben, entweder nicht käuflich zu erwerben oder die Bindung war zu instabil“, erzählt Singh.

Myzel von Fusarium verticillioides. Der Pilz verursacht unter anderem Ährenkrankheiten bei Getreiden. Die Zellwände sind vorwiegend aus Chitin aufgebaut.
Bildquelle: © Glimmerpilzchen / Wikipedia, CC BY-SA 3.0
Als nächstes scannte sie über 100.000 am Computer designte Moleküle, die als Chitin-Analoga in Frage kommen und hatte Glück. Der Computer sagte voraus, dass einige der Moleküle nahezu perfekt in das katalytische Zentrum der Chitin-Deacetylase hineinpassen und es blockieren würden. Die Modellierungen zeigten aber, dass die meisten dieser Kandidaten nur eine instabile Bindung ausbilden würden – sie kamen daher nicht in Betracht. Doch die Modelle sagten zumindest für ein Molekül eine stabile Bindung voraus. „Es ist erstaunlich, was die Bioinformatik leisten kann“, freut sich Bruno Moerschbacher.
Bisher fand die gesamte Arbeit nur am Computer statt. Jetzt ging es zum ersten Mal ins Labor. Zunächst wurde die Inhibitorwirkung der identifizierten Moleküle experimentell verifiziert. Die indischen Chemiker modifizierten dann das aktivste Molekül durch Kopplung mit einer Zucker-Gruppe. „Es war eine sehr schwierige Aufgabe, aber sie haben es geschafft“, sagt Singh. Die zusätzliche Zucker-Gruppe ist dafür da, die Spezifität des Moleküls zu erhöhen, damit es nicht aus Versehen an ähnlich aussehende Enzyme im menschlichen Körper oder in Pflanzen bindet.
Ausblick
Jetzt geht es darum, in vivo zu zeigen, ob die Vorhersagen des Computers stimmen und die Labortests zuverlässig auf die Wirkung in ganzen Pflanzen übertragbar sind. Dafür müssen Singh und ihre Mitarbeiterinnen Tests an lebenden, infizierten Pflanzen durchführen. Denn wenn Pilze auf festem oder in flüssigem Nährmedium wachsen, produzieren sie kein Chitosan. „Dort müssen sie sich nicht verstecken“, erklärt Moerschbacher.
Wenn die Versuche erfolgreich verlaufen, wollen sie ein Patent auf ihr neues Bio-Fungizid anmelden und hoffen, es eines Tages als Pflanzenschutzmittel auf dem Markt zu sehen.
Zum Weiterlesen auf Pflanzenforschung.de:
- Friedliche Invasion im Tarnumhang – Pilze tarnen ihre Zellwandstruktur, um Pflanzenabwehr zu umgehen
- Der heilige Gral der Pflanzenforschung – Neue Möglichkeit entdeckt, Pflanzen widerstandsfähiger zu machen
- Als Holobiont zum Erfolg – Eine gemeinsame Evolution hat Pflanzen und Mikroorganismen zu erfolgreichen Lebenspartnern gemacht
Titelbild: Das Projekt Bio-Fun will ein Biofungizid entwickeln, dass keine schädlichen Nebenwirkungen mehr hat. Das könnte die Landwirtschaft nachhaltiger und die Agrarlandschaften artenreicher machen. (Bildquelle: © www.pflanzenforschung.de / DALL.E)
